Determinación cualitativa de sangre oculta en heces
19.02.2020
Objetivo:
Observación de heces y determinar si es posible la presencia de sangre en ellas.Material:
- Test NADAL
- Tubo recolector
- Muestras de heces
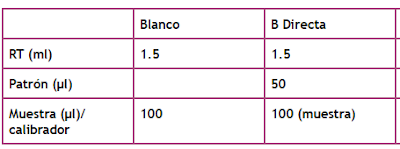
Procedimiento:
Tenemos dos muestras de heces en placa, una con sangre y otra sin sangre.1. Sujetamos el tubo verticalemnte y abrimos el tapón azul. Extraemos el aplicador.
2. Recolectamos la muestra introduciendo el aplicador en tres puntos diferentes de las heces.
3. Insertamos otra vez el aplicador con la muestra y cerramos bien el tapón.
4. Agitamos bien el tubo para que lña muestra se mezcle completamente con el buffer diluyente.
5. Desenroscamos la tapa blanca protectora del tubo de recolección. Rompemos la punta mediante un movimiento giratorio utilizando un pañuelo de papel.
6. Manteniendo el tubo recolector en vertical añadimos 3 gotas de solución en el pocillo de prueba
7. Interpretamos los resultados