PRACTICA 5 - DETERMINACIÓN CUANTITATIVA DE GLUCOSA IVD 23.10.19
SIGNIFIVADO CLÍNICO
La glucosa es la mayor fuente de energía para las células del organismo; la insulina facilita la entrada de glucosa en las células.
La diabetes mellitus es una enfermedad que cursa con una hiperglucemia, causada por un déficit de insulina.
El diagnóstico clínico debe hacerse teniendo en cuenta todos los datos clínicos y de laboratorio.
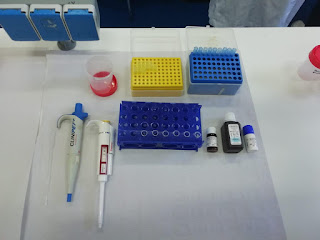
REACTIVOS
- R1 tampón
- R2 enzimas
- Glucose cal (calibrador primario de glucosa 100mg/dl)
PREPARACIÓN
Reactivo de trabajo (RT): Disolver el contenido de un vial de R2
Enzimas en un frasco de R1 Tampón
Tapar el vial y mezclar suavemente hasta disolver su contenido.
MATERIAL ADICIONAL
- Espectofotómetro o analizador para lecturas de 340 nm
- Cubetas de 1.0 cm de paso de luz
- Equipamiento habitual de laboratorio: pipetas con sus respectivas puntas y cementerio.
MUESTRAS
- Suero o plasma libre de hemólisis
- Orina
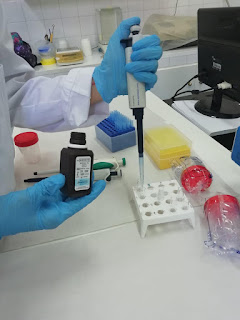
Procedimiento:
1.Preparamos las condiciones de ensayo:
2.Ajustar el espectofotrómetro a cero frente a agua destilada
3.Pipetear en una cubeta:
4.Mezclar e incubar 5 min a 37ºC
5.Leer la absorbancia de calibrador y la muestra frente al blanco de reactivo.
Patrón- 0.308
Muestra-0.665
NOTA: cada fase se tiene que hacer inmediatamente para que el resultado no sea alterado.
- Longitud de onda 340nm
- Cubeta de 1cm de paso de luz
- Temperatura 37ºC/15-25ºC
2.Ajustar el espectofotrómetro a cero frente a agua destilada
3.Pipetear en una cubeta:
4.Mezclar e incubar 5 min a 37ºC
5.Leer la absorbancia de calibrador y la muestra frente al blanco de reactivo.
Patrón- 0.308
Muestra-0.665
NOTA: cada fase se tiene que hacer inmediatamente para que el resultado no sea alterado.