PRÁCTICA 9 - Medición de Hemoglobina Glicosilada (HbA1c)
OBJETIVO:
La prueba de la hemoglobina glicosilada (HbA1c) es un examen de sangre para la diabetes tipo II y la prediabetes.Mide el nivel promedio de glucosa en sangre durante los últimos 3 meses.Los facultativos pueden usar la prueba HbA1c sola o en combinación con otras pruebas de diabetes para hacer un diagnóstico.La HbA1c también es utilizada para comprobar el control que sigue el paciente diabético sobre sus niveles de glucosa/insulina.
MATERIALES:
- Micropipetas de 5 y 25 μL.
- R1 → solución tampón de glicinamida que contiene ácido bórico conjugado con un colorante y detergentes (reactivo).
- R2 → solución de NaCl tamponada a la morfolina y detergentes (solución de lavado).
- Muestra → sangre anticoagulada con EDTA.
- Puntas de pipeta
- Disco con membrana (TD/Dispositivo-test)
- NycoCard READER II
Lectura con el aparato NycoCard READER II
1.Se realiza el blanco de la muestra, para ello el equipo consta de un disco con membrana sin muestra integrado.
2.Se coge el lápiz de lectura.
3.Se coloca la punta del lápiz en la membrana del disco y se baja el diafragma que tiene integrado el lápiz.
NOTA: la bajada del diafragma debe realizarse rápidamente para no falsear los resultados.
4. Se lee la medida en la pantalla del aparato.
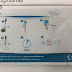
PROCEDIMIENTO
1. Añadir 5 μL de sangre completa en el tubo de ensayo prellenado con el R1 (reactivo).
2. Mezclar bien y dejar reposar durante 2-3 minutos.
NOTA: el tiempo no debe ser menos a 2 minutos, ni mayor a 3 minutos.
3. Mezclar nuevamente con el fin de obtener una suspensión homogénea.
4. Depositar 25 μL de la mezcla sobre el TD/Dispositivo-test manteniendo la micropipeta separada al menos 0.6 cm de la placa del testo.
NOTA: evitar la formación de burbujas de aire.
5. Dejar penetrar completamente la mezcla reactiva en la membrana del dispositivo.
6. Esperar un mínimo de 10 segundos.
7. Añadir 25 μL de la R2 (solución de lavado) sobre la palca dispositivo.
8. Dejar penetrar la solución de lavado completamente sobre la membrana.
9. Esperar un mínimo de 10 segundos.
NOTA: evitar la formación de burbujas de aire.
RESULTADO
El resultado de la medición fue de 9.8%, un valor un poco bajo respecto a los valores de referencia.